背景介绍
由于大的比表面积、长时间的血液循环以及主动或被动的肿瘤或其他特定器官的靶向性,纳米凝胶成为纳米医学材料的理想候选者。通过静电相互作用、反相微乳液、去溶剂/凝聚、疏水相互作用或单体交联等方式构建的纳米凝胶在生物医学中展现了优异的应用价值,而在构建纳米凝胶的过程中将其它材料结合制备的复合纳米凝胶,可以被赋予成像、指导治疗、触发药物释放或光热、光动力治疗等性能。化学发光成像,是利用生物体内源性物质触发化学反应进而产生发光实现的一种成像方法,因其无需外部激发光而避免生物背景光干扰被认为是一种超灵敏的靶向成像和检测方法。活性氧(ROS)是一类源于生物体氧代谢的中间产物,基于活性氧响应的纳米凝胶化学发光成像可以有效检测生理环境中的炎症反应产物(过氧化氢,H2O2)。而将具有化学发光能力的纳米凝胶与能产生细胞毒素的光敏剂进一步结合,在内源性化学发光光激发下,可以产生如单线态氧、羟基自由基和超氧自由基等诱导肿瘤细胞凋亡的活性氧产物,可以在化学发光成像的基础上实现癌症的化学发光光动力治疗。因此,构建具有长波长化学发光和光动力能力的复合纳米凝胶有望在免疫性疾病中实现诊断和治疗应用。
研究出发点
碳点(Carbon dots,CDs)是一种由sp2/sp3碳骨架和丰富的官能团/聚合物链组成的0维碳纳米材料,因其具有高荧光量子产率(PLQY)、可调谐发射波长、高光稳定性和生物相容性等优点而受到广泛关注。在这些不同结构的碳点中,由碳核和连接的聚合物链组成的碳化聚合物点(CPDs)被认为具有新颖的类聚合物性质,使其在各个领域具有广阔的应用前景。此外,具有窄带发射的深红色/近红外发光碳化聚合物点,由于其小的背景噪声、高的色纯度、大的组织穿透能力,已被证明可以有效提高生物成像对比度和空间分辨率。同时,在近年来的报道中,同样证明了该深红色/近红外发射的碳化聚合物点具有独特的可见光光动力能力,可实现对细菌的准确识别和杀伤。因此,利用碳化聚合物点的聚合物状结构和优异的发光特性,设计出更多适用于各种应用的智能纳米材料具有重要意义。
全文速览
基于此,郑州大学单崇新教授课题组利用具有自组装性能的碳化聚合物点设计构建了具有活性氧成像和光动力治疗双重功能的化学发光纳米凝胶(CCNG)。
在实际研究中,研究者以不同的生物质材料(鱼腥草、金银花、艾草、紫苏和红豆杉)制备出五种单分散碳化聚合物点。这些碳化聚合物点具有类似聚合物的性质,可以通过亲水和疏水相互作用自组装成纳米聚集体。这些碳化聚合物点在二[2,4,5-三氯-6-碳戊氧基苯基]过氧酸盐(CPPO)-过氧化氢化学发光体系中表现出高效的深红色/近红外化学发光,同时其在水溶液中表现出独特的光动力性能。在此基础上,研究者以这些碳化聚合物点作为构建化学发光平台的单体,通过参与两亲性聚合物(Pluronic 127,F127)和化学发光供体(CPPO)的自组装,制备了具有过氧化氢响应的水溶性化学发光纳米凝胶(CCNG)。从机理上讲,炎症部位产生的过氧化氢可与CPPO反应,其生成的高能中间体可以与碳化聚合物点之间发生电子交换转移发光(CIEEL),从而实现体外和体内化学发光成像。同时,在内源性化学发光激发下,诱导CCNG中的碳化聚合物点产生单线态氧、羟基自由基和超氧自由基等多类型活性氧并诱导肿瘤细胞凋亡,从而抑制肿瘤生长。进一步实验研究表明,该化学发光碳纳米凝胶在检测动物模型中的炎症方面表现出优异的成像质量,同时其在肿瘤引起的免疫环境中被证明具有肿瘤靶向性和高效的抗肿瘤效果。
其研究成果以“Near-infrared chemiluminescent carbon nanogels for oncology imaging and therapy”为题发表于SmartMat上。该文章第一作者为郑州大学沈成龙助理研究员、郑州大学第一附属医院蒋天赐主治医师,通讯作者为郑州大学单崇新教授、娄庆副教授和郑州大学第一附属医院程哲教授。
图文解析
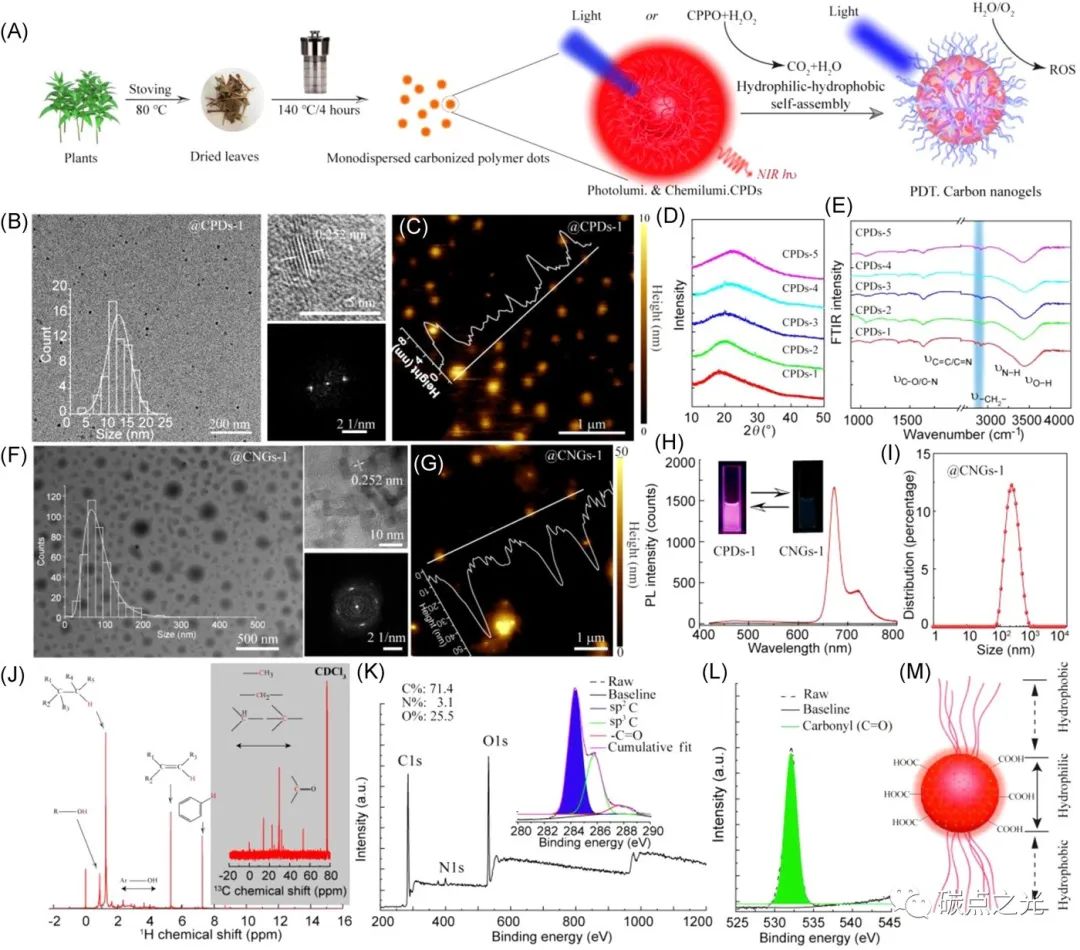
图1. 碳化聚合物点的合成及其组装。(A) CPDs及CNGs制备示意图。(B) CPDs-1的透射电子显微镜、高分辨率TEM图像和选区电子衍射图案。(C) 原子力显微镜(AFM)图像。(D) CPDs的XRD图谱。(E) CPDs的傅里叶变换红外光谱。(F) CNGs-1的TEM(左)和HRTEM(右上)图像以及SAED(右下)模式。(G) CNGs-1的AFM图像。(H) CPDs-1在乙醇和CNGs-1在水中的PL。(H) CNGs-1在水溶液中的动态光散射(DLS)分布。
如图1所示,本研究选择了五种常用的中草药植物制备碳化聚合物点。鱼腥草、金银花、艾条、紫苏和红豆杉生物质材料是实现深红色/近红外发射碳化聚合物点的理想碳源。如实验部分所述,通过溶剂热处理鱼腥草、金银花、艾条、紫苏和红豆杉可获得五种单分散碳化聚合物点。此外,研究者还发现,当这些碳化聚合物点的溶剂从乙醇转化为水时,其可以发生自发聚集。为方便起见,从鱼腥草、金银花、艾草、紫苏和红豆杉中提取的这些碳化聚合物点分别被命名为CPDs-1、CPDs-2、CPDs-3、CPDs-4和CPDs-5。如图1B所示,这些CPDs-1的透射电子显微镜(TEM)呈现出圆点形状,其单峰大小分布在2到25 nm之间。CPDs-1的高分辨率TEM(HRTEM)图像和相应的选区电子衍射图案显示了0.252 nm的高分辨率晶格间距,对应于石墨碳结构的(110)晶面间距。原子力显微镜(AFM)图像表明这些碳化聚合物点的高度小于10 nm(图1C)。同时,这些碳化聚合物点的X射线衍射图显示,主峰位于23.1°左右,其归因于石墨(002)晶格间距(图1D)。傅立叶变换红外光谱(图1E)在2800 cm-1左右的振动峰可归因于−CH2−证明了这些碳化聚合物点表面存在的烷基长链。当用于分散这些纳米颗粒的溶剂从乙醇改为高极性水时,这些碳化聚合物点可以通过疏水作用进一步自组装形成更大的纳米凝胶。如图1F所示,由CPDs-1形成的CNGs-1呈现出平均直径为50 nm的麻粒状形状,相似的晶格间距为0.252 nm,这些表征意味着形成的纳米凝胶只有尺寸变化,但结构核心没有变化。同样,类似的CPDs-2、CPDs-3、CPDs-4和CPDs-5可以分别形成CNGs-2、CNGs-3 CNGs-4和CNGs-5。而CNGs-1的AFM图像显示CNGs-1的高度也增加到50 nm左右(图1G)。同时,纳米凝胶在水中的对应光致发光强度远低于碳化聚合物点在乙醇中的对应光致发光强度,这间接证实了碳化聚合物点的纳米聚集体在水中形成,并引起光致发光强度的聚集猝灭(ACQ)(图1H)。此外,动态光散射(DLS)图像表明,这些纳米凝胶的动力学直径约为100 nm,这比TEM图像中观察到的尺寸大,其可以归因于碳化聚合物点表面上有聚合物链。
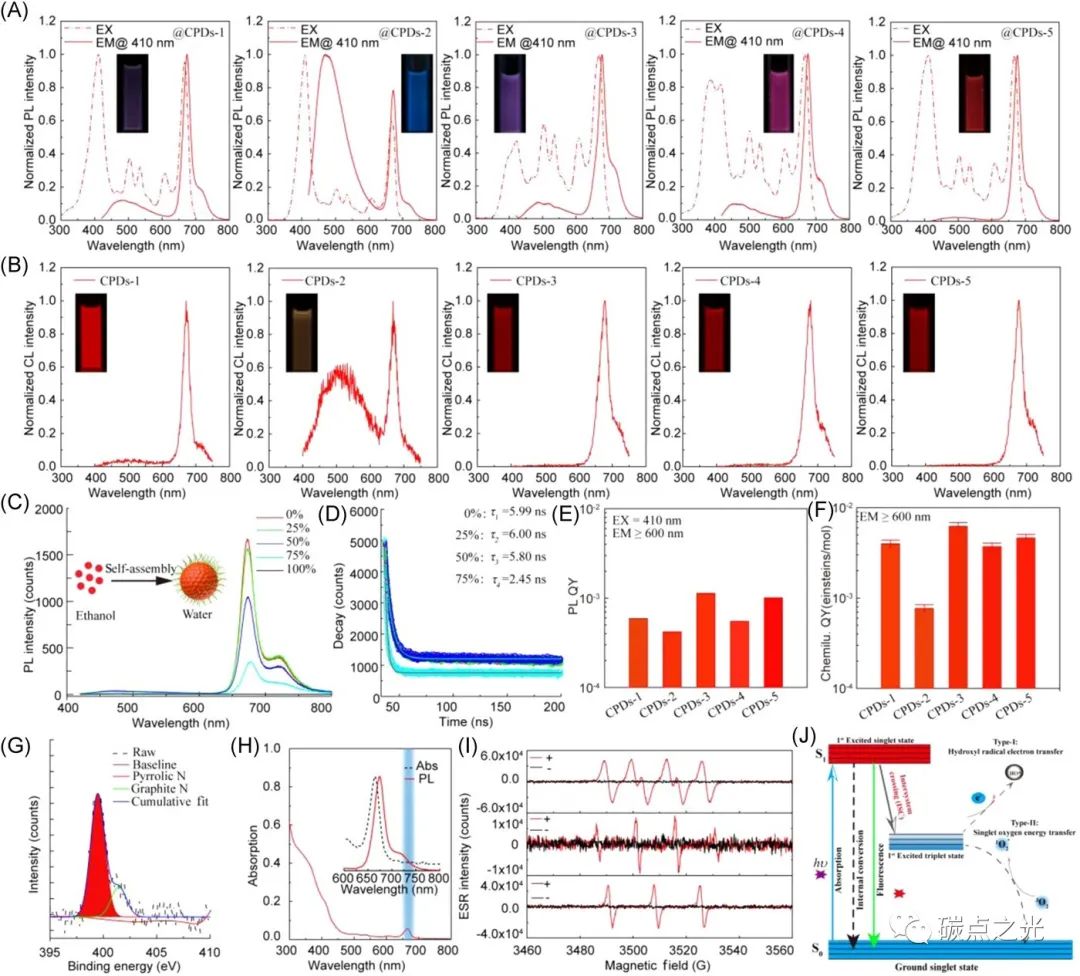
图2 碳化聚合物点的发光和其聚集体的光动力。(A) 五种碳化聚合物点在乙醇溶液中的光致发光(PL)激发(EX)和发射光谱。(B) 五种碳化聚合物点的化学发光光谱。(C) CPDs-1在水/乙醇混合物中的发光强度随着水百分比的增加而降低。(D) CPDs-1在水/乙醇混合物中随含水率增加的时间分辨衰减光谱。(E) 五种碳化聚合物点在410nm激发下的PL QY。(F) 五种碳化聚合物点在600至800 nm的范围的CL QY。(G) CPDs-1的高分辨率XPS N1s谱。(H) CPDs-1的吸收光谱。(I) CNGs-1在光照下的ESR光谱,用于检测单线态氧、羟基自由基和超氧自由基。(J)在光或化学反应中的电子转移机制。
除了自组装特性外,这些碳化聚合物点还表现出优异的光致发光和化学发光性能,同时其相应的纳米凝胶表现出很好的光动力性能。如图2A所示,碳化聚合物点乙醇溶液表现出从紫外(UV)到近红外(NIR)区域的吸收,同时其在紫外光下具有窄的半高宽的深红色/近红外的光致发光。此外,在双草酸酯-过氧化氢体系中,这些碳化聚合物点的化学发光也表现出相同的深红色/近红外发射和较窄的半高宽特征。如图2B所示,当这些碳化聚合物点与CPPO和H2O2混合时,可以观察到肉眼可见的明亮持久的深红色/近红外化学发光。与光致发光类似,这些碳化聚合物点的化学发光光谱峰值约为670 nm,半高宽约为20 nm。此外,这些碳化聚合物点在不同含水量的水/乙醇混合物中的PL逐渐减弱(图2C),其光致发光寿命随着含水量的增加而逐渐降低(图2D),同样证明了水可以促使碳化聚合物点聚集成大的聚集体。对于CPDs-1、CPDs-2、CPDs-3、CPDs-4和CPDs-5,这些碳化聚合物点在410 nm激发下的绝对荧光量子产率分别为0.59%、0.42%、1.13%、0.55%、1.01%(图2E)。以光泽精-过氧化氢反应为参考,不同碳化聚合物点相应的化学发光量子产率为3.98×10−3, 7.68×10−4, 6.21×10−3, 3.70×10−3, 4.62×10−3 einstein/mol(图2F),其大小与以往报告的近红外发光染料相当。根据这些表征和以前的报道,可以推断碳化聚合物点的深红色/近红外发射的机理,对于碳化聚合物点,可以观察到670 nm的类似发射峰和约6.0 ns的荧光寿命,其符合单指数函数(图2D),表明这些碳化聚合物点具有类似的荧光发射中心。而这些碳化聚合物点的XPS N1s谱 证明了吡咯氮和石墨氮的存在,证明了这些碳化聚合物点的深红色/近红外发射来自与碳核的氮元素相关的局域态(图2G)。同时,窄的半高宽和肩发射峰也表现出碳化聚合物点的典型的局域态发射特性。当这些碳化聚合物点在水中转化为聚集体时,这些聚集体在670 nm处显示出类似的发射峰,而当聚集度提高时,它们相应的荧光衰减曲线呈现出逐步降低的荧光寿命。结合TEM和AFM图像观察到的碳化聚合物点和聚集体,可以得出结论,表面带有疏水基团的碳化聚合物点表现出不同的聚合物性能,其可以形成不同大小的纳米聚集体,从而产生不同的光物理性质。此外,这些碳化聚合物点表现出强烈的自吸收,其吸收和发射之间有很大的重叠(图2H)。在这种情况下,碳化聚合物点在光照下在水溶液中表现出高效的活性氧生成能力。如图2I所示,不同的活性氧产物,如不依赖氧的I型光化学自由基(超氧自由基和羟基自由基)以及氧依赖的II型光化学单氧(单线态氧)均可以在光照下的水溶液中有效生成。基于上述特征,研究者提出了碳化聚合物点的电子传递模型(图2J)。在光或化学激发后,碳化聚合物点的基态电子将被激发到与氮有关的局域态。部分电子将通过辐射复合转移到基态,并产生深红色/近红外发光,而在水溶液中,单分散的碳化聚合物点会聚合成大的聚集体,其可以通过能量转移(ET)过程诱导强烈的自吸收和ACQ,其增加了系统间的交叉率,因此,部分激发态电子将转移到H2O和环境溶解氧中,进而产生羟基自由基和单线态氧,使碳化聚合物点的聚集体具有光动力性能。
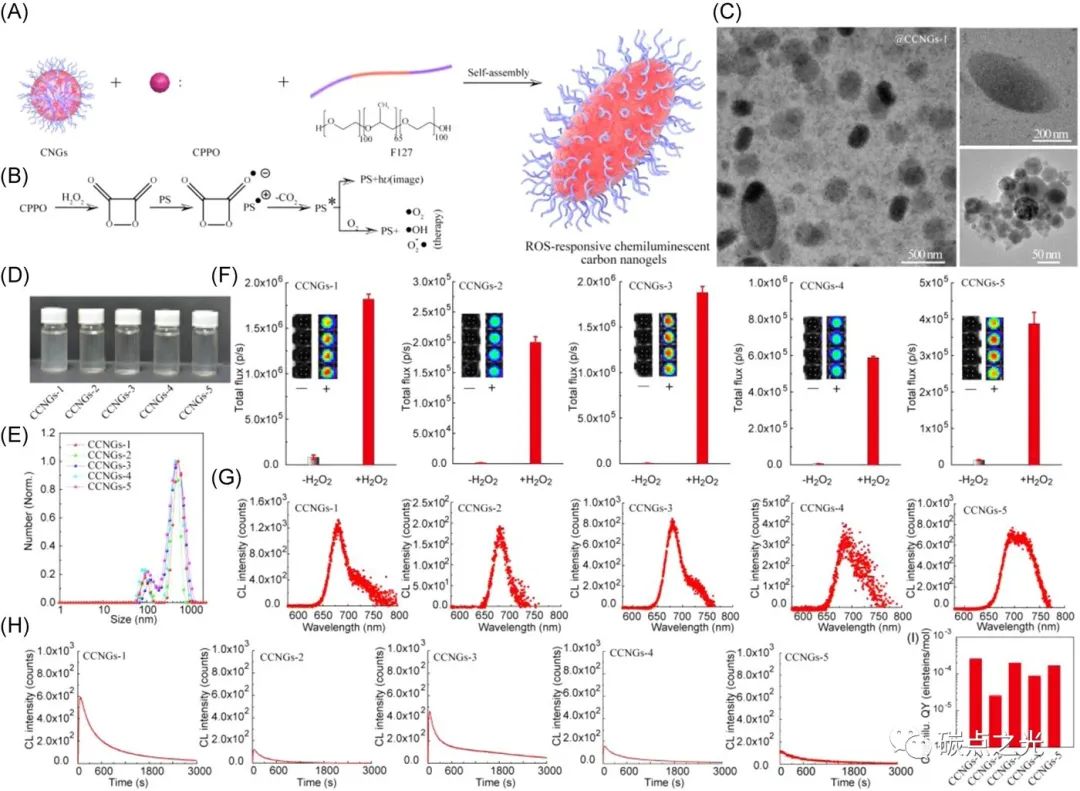
图3. 活性氧响应CCNG的设计和合成。(A) CCNG制备示意图。(B) CCNG在存在H2O2时的发光和光化学反应过程。(C) CCNGs-1的TEM图像和不同尺寸纳米颗粒的HRTEM图像。(D) CCNGs水溶液的照片。(E) CCNG的DLS分布。(F) CCNG在50 μmol/L H2O2 PBS溶液存在时的化学发光强度。(G和H)通过向H2O2中添加 CCNGs水溶液来测量的化学发光发射光谱(G)和动态化学发光强度(H)。(I)五种CCNG的化学发光量子产率。
由于类聚合物和出色的化学发光性质,研究者以这些碳化聚合物点为基础将其与聚合物(Pluronic 127,F127)和化学发光供体(CPPO)为进行纳米组装,制备具有活性氧响应的化学发光纳米凝胶(图3A)。当这些化学发光纳米凝胶暴露于H2O2时,CPPO和H2O2之间的反应可以产生高能中间体,该中间体可以通过化学反应推动的电子交换过程激发碳化聚合物点。然后,被中间体激发的碳化聚合物点可以表现出光敏剂分子的性质,其将从激发态跃迁至基态,或将电子转移到H2O和氧气,从而产生深红色/近红外化学发光或生成具有细胞毒性的活性氧。由于生物体内氧化生物中的活性氧(H2O2)最为丰富,CCNG可引发深红/近红外化学发光,其可用于克服传统荧光成像和光动力治疗的穿透深度的限制(图3B)。如图3C所示,TEM和HRTEM图像显示,CCNGs具有单分散的形态,其尺寸范围为10至1000 nm。通过优化不同的图像,可以发现这些纳米凝胶由两种纳米颗粒组成,其中直径为100至1000 nm的大颗粒由CPDs、CPPO和F127组装而成,直径为10至100 nm的小颗粒由F127和CPPO自组装。由这些碳化聚合物点制备的CCNG可以很好地分散在水中(图3D)。此外,CCNG的动态光散射显示了两个动力直径,范围为10至100 nm和100至1000 nm(图3E),与透射电子显微镜图像。研究者进一步利用活体成像系统(IVIS)研究了CCNG在水溶液中的化学发光性质。如图3F所示,在1mL H2O2(50 μmol/L)中,50 μL CCNG(10 mg/mL)的化学发光信号远高于空白组,证明CCNG对外源性过氧化氢的高响应性。如图3G所示,这些CCNG表现出深红色/近红外化学发光发射光谱,其峰值约为680 nm,半高宽约为20 nm,这些与它们的光致发光光谱相同。同时,这些CCNG的化学发光可以持续40分钟以上,这有益于用于长周期生物成像(图3H)。而CCNGs-1、CCNGs-2、CCNGs-3、CCNGs-4和CCNGs-5的相应化学发光量子产率为2.521×10−4, 2.499×10−5, 1.929×10−4, 8.54×10−5和1.63×10−5 einstein/mol。
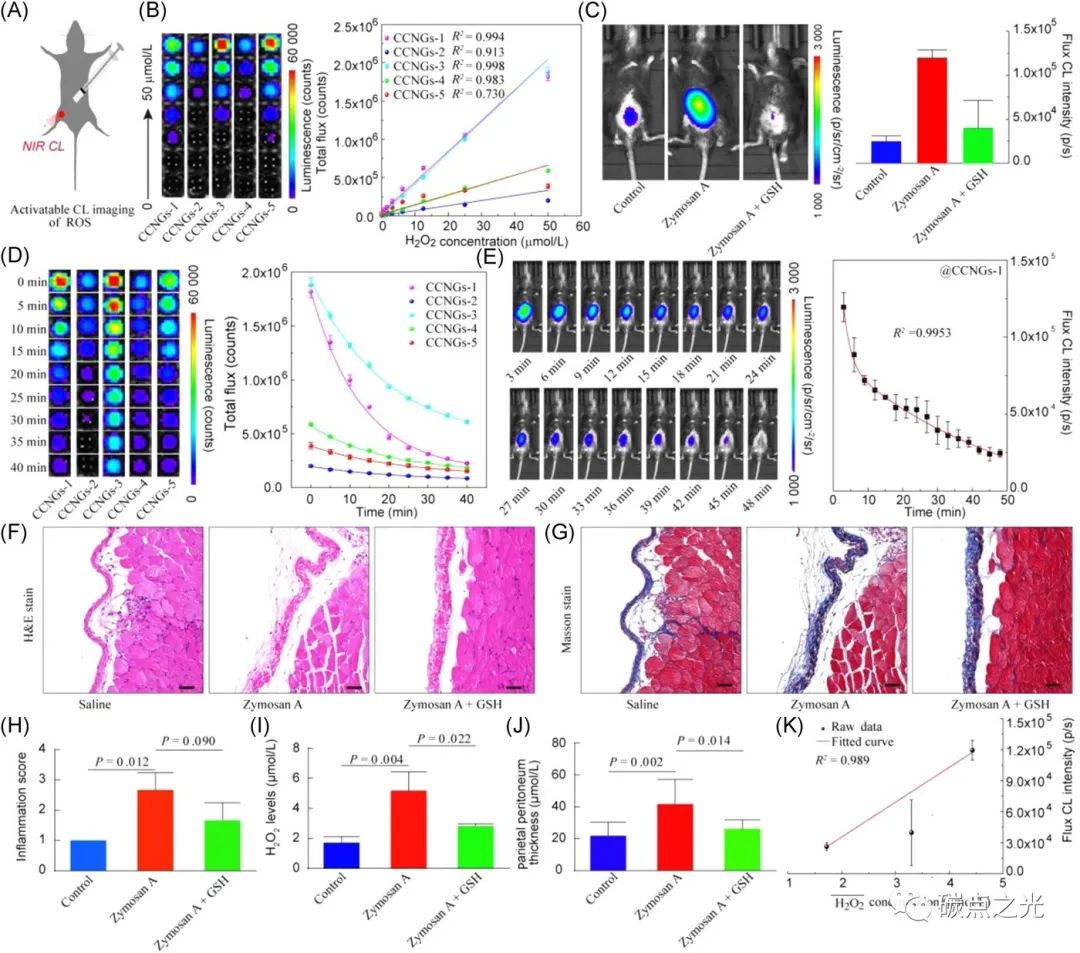
图4 炎症的体外和体内活性氧反应性化学发光成像。(A) 活性氧(ROS)的可激活CL成像示意图。(B) 在不同浓度的H2O2-PBS溶液中,不同CCNG的化学发光图像(左)和相应的化学发光强度(右)。(C)生理盐水、酵母多糖A和酵母多糖A加谷胱甘肽处理的腹膜炎小鼠模型中内源性H2O2的活体化学发光成像(左)和相应的定量化学发光强度(右)。(D) 在50 μmol/L H2O2 PBS溶液中,不同CCNG的时间分辨化学发光成像(左)和相应的化学发光强度(右)。(E)在腹腔注射酵母多糖的腹膜炎小鼠模型中,这些CCNG的时间分辨CL成像(左)和相应的量化CL强度(右)。(F和G)生理盐水、酵母多糖A和酵母多糖A加谷胱甘肽处理处理的小鼠结肠组织H&E染色切片的显微图像(F)和HAI数值(G)。(H-J)生理盐水、酵母多糖A和酵母多糖A加谷胱甘肽处理的小鼠的炎症数值(H)、壁腹膜厚度(I)和H2O2水平(J)。(K) 发光强度与H2O2水平的相关性分析。
由于长时间持续发光和近红外光具有的深度穿透的优点,这些CCNG被用于体内和体外活性氧的化学发光生物成像(图4A)。在磷酸盐缓冲液(PBS)中,这些CCNG,这些CCNG的化学发光强度与过氧化氢浓度在0~ 50 μmol/L之间呈显著线性关系。由于过氧化氢是生物体内活性氧的主要成分,其过量产生与炎症相关的疾病(如癌症、关节炎、慢性阻塞性肺疾病和神经退行性疾病)具有密切关系。因此,通过炎症成像监测生物体内过氧化氢的浓度,可用于相关疾病的检测和诊断。通过酵母多糖A可诱发小鼠急性腹膜炎而产生过量的炎症响应性活性氧,在此情况下,研究者通过腹腔注射酵母多糖A建立了炎症小鼠模型。在通过酵母多糖A诱发小鼠腹膜炎24小时后注射300μL CCNGs-1,通过小动物成像仪捕捉小鼠的化学发光成像,可以发现酵母多糖A处理小鼠的化学发光信号是对照组小鼠的2.5倍(图4C)。而用抗氧化剂谷胱甘肽(GSH)治疗腹膜炎小鼠后,酵母多糖A/GSH处理的小鼠的化学发光信号强度降低约40%。作为一种炎症到正常的对比信号,增强到减弱的化学发光信号强度可以有效地监测活体动物炎症疾病的变化。此外,在PBS中存在过氧化氢的情况下,这些CCNG的化学发光强度呈指数下降,其可被成像装置监测时间超过40分钟(图4D和图4E)。这些研究表明,CCNGs可作为活体炎症反应性显像剂,可用于长期生物成像和疾病监测。最后,腹膜组织染色切片的组织学分析也证实了炎症成像。如图4F和4G所示,在H&E染色的切片上可以观察到正常的微观结构,管腔表面笔直,紧密排列的小管接近粘膜肌层和大量杯状细胞。此外,研究发现,这些CCNGs的化学发光强度与不同条件下的炎症指数相一致(图4H),同时,小鼠模型中的H2O2水平和中性粒细胞数量同样与小鼠炎症程度具有正相关性(图4I和4J)。相关分析进一步证实内源性活性氧的增加导致的化学发光增强(图4K)。上述结果表明,这些生物质衍生碳化聚合物点可以用于构建不同炎症疾病响应的生物成像纳米探针。
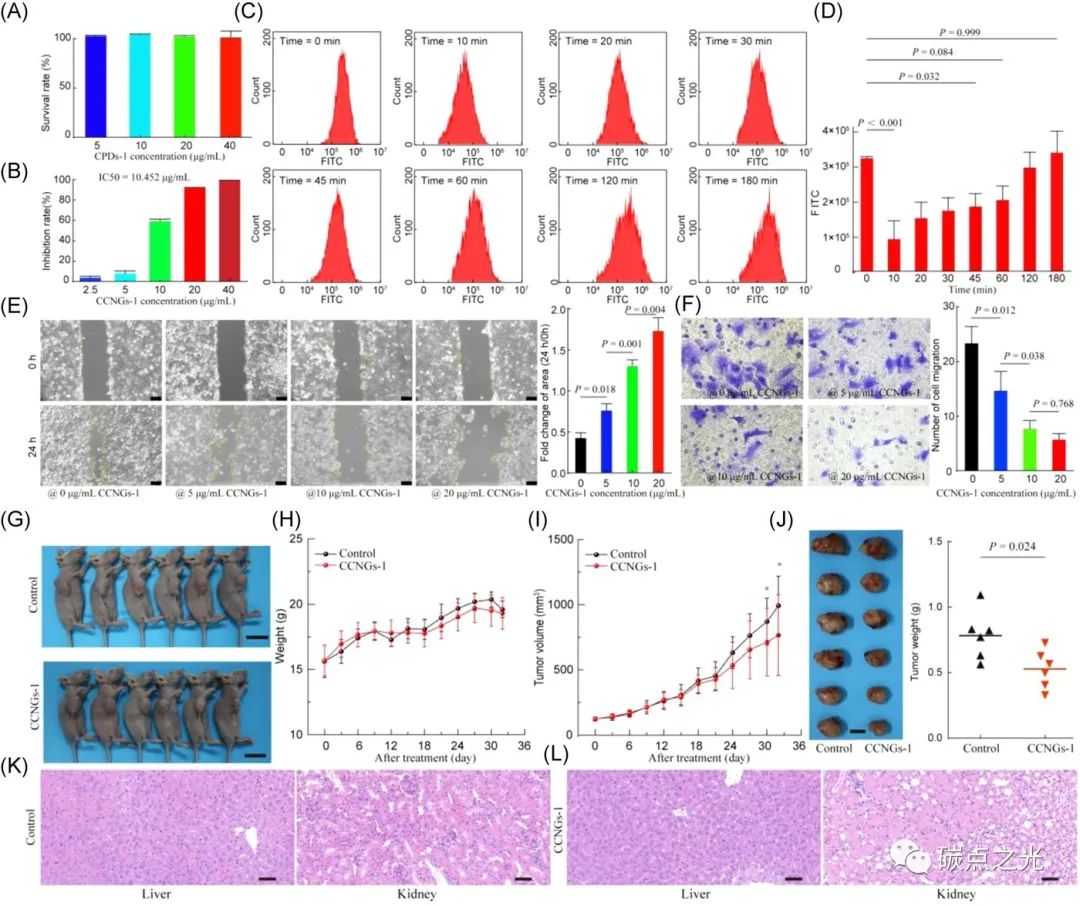
图5 CCNGs的体外和体内抗肿瘤性能。(A) 不同浓度CPDs-1孵育的细胞的存活率。(B) 不同浓度CCNGs-1孵育的细胞的存活率。(C和D)以DCFH-DA为探针孵育的CCNGs-1处理和未处理的A549细胞中活性氧浓度的流式细胞仪测定(C)和定量数据(D)。(E) 通过伤口愈合实验观察CCNGs-1处理后A549细胞的显微图像(左)和定量变化(右)。(F) 通过transwell分析,经CCNGs处理的A549细胞迁移的显微图像(左)和定量变化(右)。(G)对照组和CCNGs-1处理组小鼠的照片。(H和I)对照组和CCNGs-1处理组的小鼠体重(H)和肿瘤体积(I)的变化。(J)切除肿瘤的照片(左)和定量重量(右)。(K和L)对照组(K)和CCNGs-1处理组(L)的小鼠肝脏和肾脏H&E染色切片的显微图像。
在肿瘤微环境中,由于免疫响应机制表现出高浓度H2O2的状态。因此,除了作为免疫响应的生物成像纳米探针外,CCNG还具有作为抗肿瘤纳米药物的潜力。如图5A和5B所示,研究者研究了CPDs-1和CCNGs-1的细胞毒性,当CPDs-1的浓度高达40 μg/mL时,A549细胞仍具有接近100%的存活率,证明了碳化聚合物点高的生物相容性。相比之下,CCNGs-1显示出更高的肿瘤细胞毒性,其IC50值为10.452 μg/mL,证明了其在癌症治疗中的潜在应用。而使用商用活性氧探针(DCFH-DA)测试经CCNGs-1处理的A549细胞的活性氧,可以发现肿瘤细胞内的活性氧含量呈现持续的变化,证明了CCNGs-1与肿瘤细胞中的活性氧之间的缓慢相互作用(图5C和5D),在这个过程中,DCFH-DA的荧光发射可以被活性氧激活,而随着CCNGs-1的加入,其荧光强度迅速降低,这意味着CCNGs-1和H2O2之间发生了反应。然后,随着时间的推移,DCFH-DA的荧光强度缓慢增加,在180分钟内恢复到初始状态,证明了随着CCNGs-1的耗尽,肿瘤细胞的活性氧逐渐恢复至初始状态。作为证明,CCNGs-1由于具有的I型和II型光化学反应生成活性氧的能力,被进一步用作治疗癌症的纳米药物。如图5E所示,在A549细胞的伤口愈合试验中,用CCNGs-1处理的细胞的划痕区域显示了对伤口愈合的明显抑制,其中用CCNGs-1处理的褶皱变化区域大约是没有CCNGs-1的2倍。同时,在A549细胞的侵袭能力测定中,CCNGs-1明显削弱了A549细胞的侵袭能力(图5F),其中细胞迁移数为20 μg/mL−1 CCNGs-1大约是不含CCNGs-1的一半。除了细胞和组织验证外,CCNGs-1对小鼠实体瘤模型中的肿瘤抑制效果进一步被评估,在实验中,在33天的治疗期内,每3天记录一次小鼠的体重、肿瘤长径和短径。如图5G所示,在实验过程中,所有小鼠均存活,而在肿瘤内给药后,CCNGs-1治疗组的小鼠的肿瘤体积小于生理盐水处理的对照组,表明CCNGs-1具有治疗效果。而CCNGs-1治疗组和生理盐水对照组的体重增加程度几乎相同(图5H),证实不同处理无明显副作用。同时,肿瘤体积增加的程度同样表明CCNGs-1具有抗肿瘤功效(图5I),以及小鼠得肝脏和肾脏的H&E染色切片证明了CCNGs-1的安全性(图5K和5L)。
在A549细胞中,CCNGs介导的抗肿瘤的机制被进一步研究。如图6A所示,CCNGs-1以剂量和时间依赖性的方式诱导A549细胞凋亡,而随着CCNGs-1剂量的增加和治疗时间的延长,A549细胞表现出更高的凋亡率,表明凋亡可能是细胞死亡的主要原因(图6B)。同时,TUNEL和caspase-3染色分析显示了CCNGs-1治疗小鼠和对照组小鼠肿瘤组织切片中不同的细胞凋亡(图6C)。用活性氧探针-DHE评估CCNGs-1治疗后肿瘤组织的活性氧可以发现,肿瘤细胞表现出更多的活性氧(图6D),表明在氧化条件下,CCNGs-1产生1O2是由活性氧诱导的。此外,H&E染色试验也评估了肿瘤的增殖活性,与对照组相比,经CCNGs-1治疗的小鼠显示出更严重的肿瘤细胞凋亡或坏死,肿瘤组织中的血管被破坏(图6E和6F)。这些结果证实了CCNGs诱导的细胞凋亡是通过线粒体凋亡途径介导的。
图6. CCNGs的肿瘤抑制机制。(A和B)流式细胞术分析(A)和凋亡率的定量数据(B)。(C)石蜡切片中细胞凋亡的TUNEL Cle-Cas3和DAPI标记分析(左)和定量分析(右)。(D) 共聚焦显微镜图像(左)和定量分析(右)显示的DHE探针孵育的A549细胞中的活性氧。(E和F)对照组(E)和CCNGs-1治疗组(F)的小鼠的肿瘤H&E染色切片的显微镜图像。(G) 在使用/不使用CCNGs-1处理的A549细胞中,caspase-3蛋白相关的代表性Western印迹条带(左)和定量分析(右)。(H) CCNGs-1的肿瘤抑制机制示意图。
为了验证这一假设,研究者进一步进行了Western分析,可以发现CCNGs-1处理A549细胞后,caspase-3和bax水平显著升高(图6G)。在caspase介导的细胞凋亡中,caspase-3是负责启动细胞凋亡。这些分子的激活共同揭示了CCNGs-1通过凋亡途径诱导细胞死亡。这些数据表明,CCNGs诱导的细胞凋亡是通过线粒体凋亡途径介导的。在此情况下,CCNGs的抗肿瘤机制如下:当CCNG进入肿瘤部位时,肿瘤细胞内的内源性H2O2会触发化学发光,同时激发态碳化聚合物点可以产生细胞毒性的I型光化学自由基和氧依赖型II光化学单氧,这些活性物质可以有效激活caspase,并通过介导细胞凋亡实现抑制肿瘤生长(图6H)。
总结与展望
研究者制备了五种碳化聚合物点作为发光体,其具有高效的深红色/近红外荧光和化学发光,其发光半高宽窄于20 nm。由于它们具有类似聚合物的性质,这些碳化聚合物点可以在水溶液中自组装成聚集体。研究者利用这些碳化聚合物点与两亲性聚合物和化学发光供体进一步设计和制备了活性氧响应的化学发光纳米凝胶。CCNGs的发光与环境H2O2水平呈正相关,具有较高的检测灵敏度和特异性,优越的成像质量。此外,CCNGs可以利用肿瘤微环境中的高浓度过氧化氢生成具有细胞毒性的羟基自由基和单线态氧而不需要外部刺激,其化学发光能量传递过程产生的活性氧可以有效激活凋亡途径并诱导癌细胞死亡。考虑到这些CCNGs在诊疗一体化应用中的多种优势,其有望开发多种临床应用。