近日,张振中教授研究组构建了一种无创型纳米药物递送系统以同时克服肿瘤组织血管内皮层与细胞外基质双重屏障。相关研究成果以Simultaneously overcome tumor vascular endothelium and extracellular matrix barriers via a non-destructive size-controlled nanomedicine为题发表在Journal of Controlled release杂志。
肿瘤血管内皮层与细胞外基质最为抗肿瘤药物最主要的两层屏障,大大限制了抗肿瘤药物的疗效。本课题拟构建一种无创型纳米药物递送系统,结合一氧化氮(NO)可逆性扩血管作用与超声敏感脂质体粒径可控性,同时克服肿瘤双重屏障。首先将抗肿瘤一线药物阿霉素(DOX)通过物理吸附负载于PAMAM(5nm)中,然后与NO供体亚硝基谷胱甘肽(GSNO)共同包封在超声敏感脂质体中,最终构建一种对肿瘤血管结构具有可逆性调节作用且粒径具有可控性的药物递送系统(URL/GSNO/PD)。本课题以超声敏感脂质体作为药物转运载体,其磷脂双分子层中具有一层气体层,使其对超声具有响应性。当药物递送系统到达肿瘤组织时,在超声作用下, GSNO快速产生NO并作用于血管平滑肌,肿瘤血管扩张,同时,磷脂双分子层中的气体层逐渐膨胀致脂质体破裂,小粒子PAMAM@DOX(10nm)大量释放,结合NO可逆性扩血管作用,大量的PAMAM携带着DOX进入到肿瘤深部。由于不同类型的肿瘤模型,血管结构差异较大,因此本课题选用两种截然不同的肿瘤模型(人乳腺癌MCF-7肿瘤模型与人胰腺癌MIAPaCa-2肿瘤模型)来考察药物递送系统抗肿瘤活性。实验结果显示,相比于传统脂质体,本课题所构建的药物递送系统具有更明显的抗肿瘤活性,尤其对血管结构较成熟的MIAPaCa-2肿瘤模型的治疗作用更为明显(相比于传统脂质体,URL/GSNO/PD纳米药物系统对MCF-7、MIAPaCa-2的抗肿瘤效率分别提高了32.5% 、 56.5%)。本课题所构建的药物递送系统提供一种新的方式可逆性的调节肿瘤血管渗透性,增加肿瘤部位药物富集浓度,同时无明显毒副作用。
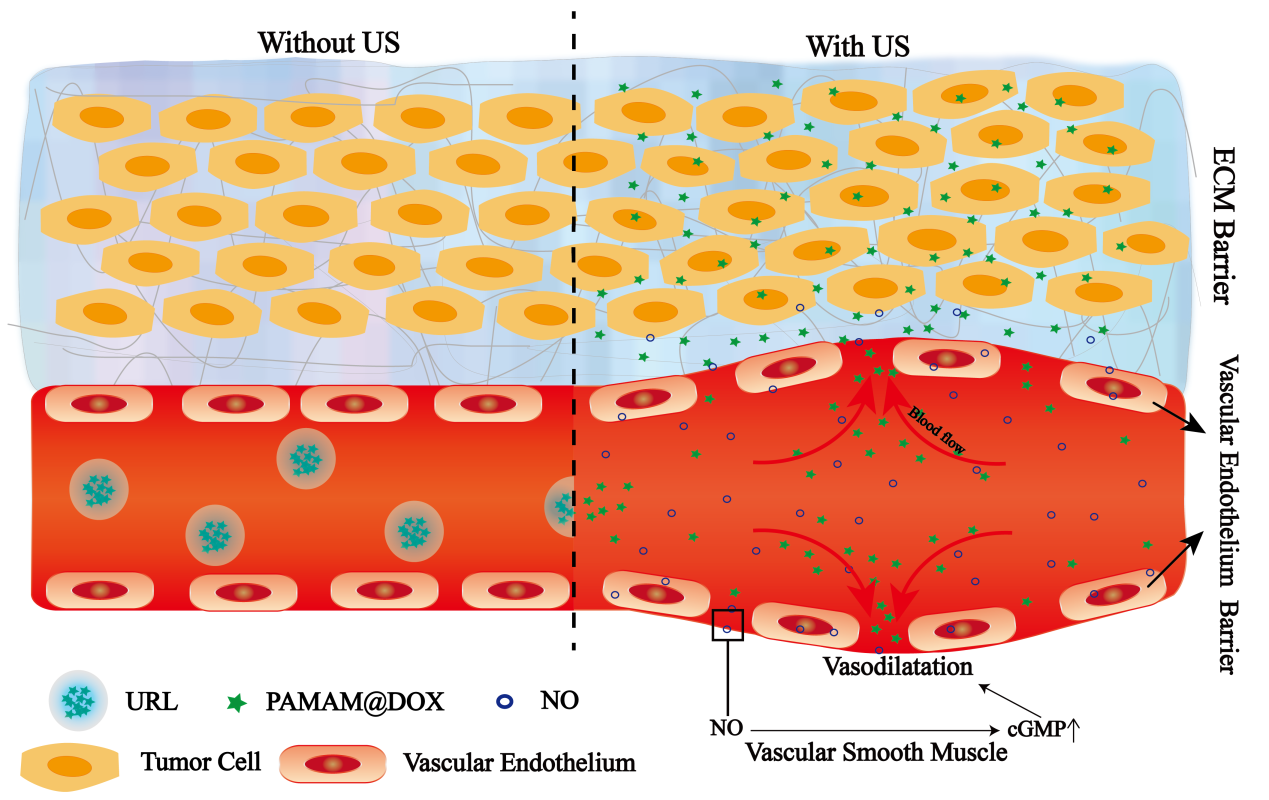
无创型纳米药物递送系统克服肿瘤组织血管内皮层与细胞外基质双重屏障的原理示意图