糖尿病肾病(DN)是糖尿病最常见的微血管并发症之一,是终末期肾病的主要病因,发病率逐年上升。蛋白尿是糖尿病肾病的常见临床表现,但目前尚缺乏有效的治疗方法。足细胞位于肾小球毛细血管外的基底膜上,处于终末分化状态。作为肾小球滤过屏障的重要组成部分,足细胞的足突和裂孔隔膜结构对维持肾功能至关重要,其损伤是导致白蛋白尿加重的关键因素,并进一步损害其它肾实质细胞群。任何引起足细胞骨架改变的因素,都可能导致足细胞损伤,例如细胞周期的重进入。
越来越多的证据表明,长链非编码RNA(lncRNA)能够与DNA、RNA及蛋白质发生相互作用,通过表观遗传、转录及转录后等多个层面调控基因表达,从而影响DN的发生和发展。然而,大多数lncRNA的具体功能尚不明确。
2024年10月29日,郑州大学第一附属医院肾内科医学部、天健先进生物医学实验室郭佳/刘章锁团队在Advanced Science在线发表题为“LncRNA evf-2 Exacerbates Podocyte Injury in Diabetic Nephropathy by Inducing Cell Cycle Re-entry and Inflammation Through Distinct Mechanisms Triggered by hnRNPU”的研究论文。该研究发现,lncRNA evf-2在DN患者的足细胞中表达上调,并与细胞周期重入和炎症反应密切相关。通过在糖尿病小鼠或培养的足细胞中特异性敲低lncRNA evf-2,可以减轻与这些过程相关的足细胞损伤,利用该团队自主研发的足细胞特异敲除evf-2的小鼠构建的DN模型,也证实了上述发现。

作者对evf-2过表达足细胞的RNA进行测序,结果表明上调的mRNA主要富集在细胞周期和炎症通路,而且细胞周期相关mRNA Ccnb1和Tacc3存在可变剪接。通过ChIRP-MS分析evf-2的结合蛋白,结果显示大部分结合蛋白在mRNA加工、RNA剪接、蛋白质折叠和核糖核蛋白复合物生物过程中富集。其中,异质性核糖核蛋白U(hnRNPU)是evf-2的主要结合蛋白,对hnRNPU的敲低可部分减轻evf-2过表达所引起的mRNA上调,并改变Ccnb1和Tacc3的剪接变体比例。这项研究首次揭示了糖尿病肾病中细胞周期相关基因的可变剪接体,并阐明了lncRNA evf-2与hnRNPU之间的相互作用。这种相互作用最终通过多种机制导致细胞周期相关基因和炎症因子的上调,可能涉及转录激活、RNA稳定性调节、可变剪接或翻译调控。
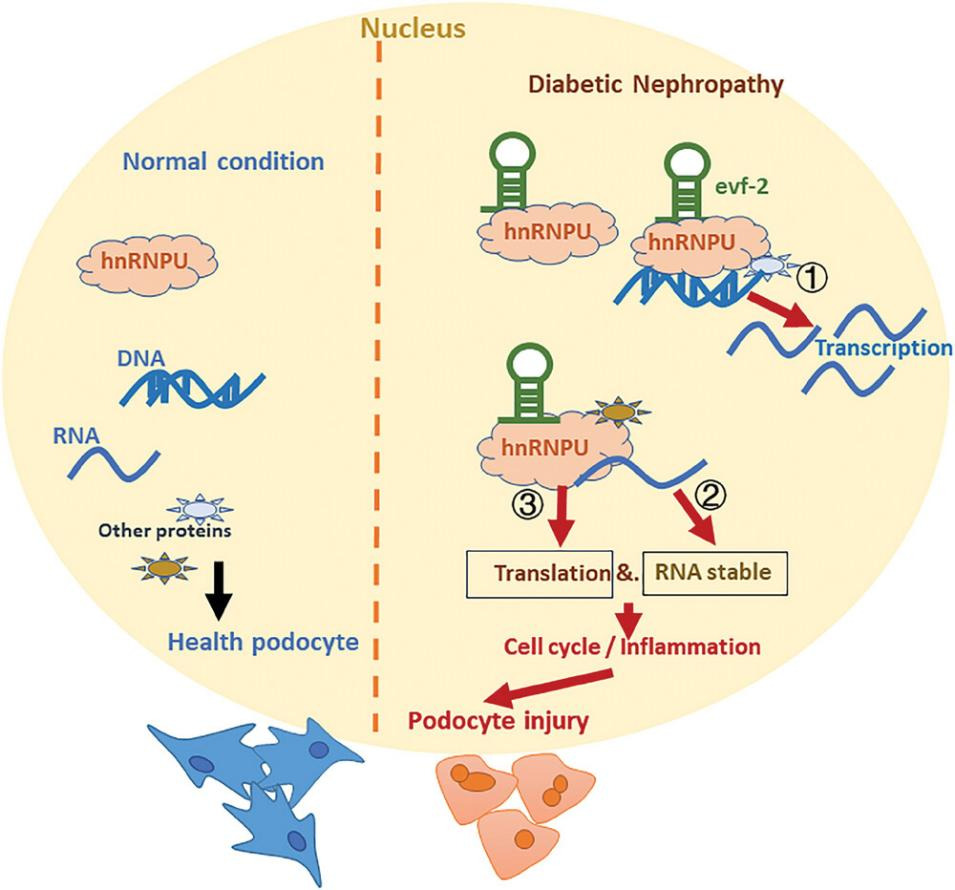
图1. lncRNA evf-2诱导DN足细胞损伤的机制。
左图:在正常情况下,lncRNA evf-2在肾足细胞中的表达较低,而hnRNPU在健康足细胞中的表达保持在基础水平。右图:在DN中,lncRNA evf-2表达上调,与hnRNPU结合,从而导致细胞周期相关基因和炎症因子的表达增加,这一过程可能通过转录激活、选择性剪接或RNA稳定性与翻译调控等机制实现。
该研究发现了lncRNA evf-2和hnRNPU之间的相互作用,通过多种机制对足细胞的细胞周期重进入和炎症反应发挥调节作用。这种调节涉及炎症因子的转录调控以及细胞周期相关蛋白的转录和可变剪接调节,还可能对其翻译过程产生影响,特别是在模拟DN或暴露于脂多糖的条件下。研究结果加深了对lncRNA evf-2和hnRNPU复合物在DN和其它足细胞病肾病背景下在DNA和RNA水平上发挥双重调节作用的理解。更重要的是,这些发现为开发针对足细胞损伤的创新治疗方法奠定了理论基础。
郑州大学第一附属医院博士研究生张超杰为该论文的第一作者,其导师郑州大学第一附属医院肾内科医学部郭佳教授、天健先进生物医学实验室刘章锁教授为本文的共同通讯作者。该研究得到了国家自然科学基金、河南省重大科技专项(公益类)、河南省科技攻关项目和天健先进生物医学实验室自主立项项目的经费支持。

原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202406532