朱平平,教授,博士生导师,国家优青。自博士期间,一直从事干细胞的干性调控机制研究。研究对象包括生理情况下的成体干细胞(如肠道干细胞)和病理情况下的肿瘤干细胞(如肠癌干细胞和肝癌干细胞),调控机制包括表观遗传调控(如非编码RNA、染色质重复复合物、DNA修饰等)和微环境调控(如免疫因子、神经递质和干性因子等),尤其关注干细胞的免疫微环境调控。以通讯作者或第一作者发表Nat Cell Biol、Nat Immunol、Neuron、Nat Struct Mol Biol、 J Clin Invest(2篇)、J Hepatol (2篇)、Nat Commum(4篇)、Cell Rep、Adv Sci等27篇论文,其中通讯/第一作者Nature/Cell子刊9 篇。获国自然区域创新发展基金重点项目、科技部重点研发、面上(2)、博新计划,中国科协青年人才托举工程等项目支持。具体研究方向如下:
一、肠道干细胞的免疫微环境调控。肠道是研究成体干细胞、组织稳态和免疫调控的经典器官。我们首次发现免疫因子IL-13在肠道干细胞和肠道稳态维持中的重要作用,揭示了肠道干细胞的免疫微环境(Nat Immunol, 2019),发现Rspo-Lgr4干性通路在肠道干细胞的自我更新维持和肠癌发生中的重要作用及调控机制(Nat Cell Biol, 2018),并发现调控肠道干细胞自我更新的关键因子circBtnl1(EMBO J, 2023)。代谢调控方面,我们发现肠道稳态时,菌群代谢物VA(戊酸)能够促进五羟色胺神经元分泌5-HT,活化PGE2+巨噬细胞,通过PGE2促进肠道干细胞的干性维持(Cell Res, 2022)。
二、肿瘤干细胞与肿瘤癌变机制。肿瘤干细胞具有超强的致瘤能力和自我更新潜能,靶向肿瘤干细胞是肿瘤治愈的新希望。我们鉴定出数个重要基因参与调控肝癌干细胞的自我更新机制(Nature Commun,2015,2016a),并发现多个lncRNA和环状RNA对肝癌和肠癌干细胞具有重要的调控作用(JCI, 2021;Cell Rep, 2021;J Heptol,2018,2019; Nat Cell Biol, 2018; Nature Commun,2016b),还揭示了肿瘤的固有免疫调控新机制(Adv Sci, 2022)。代谢调控方面,我们发现肠癌发生时,肿瘤相关的菌群代谢物IVA(异戊酸)通过5-HT促进肠癌干细胞的自我更新和肠癌发生(Neuron, 2022),还鉴定出肝癌干细胞线粒体DNA表达的环状转录物mcPGK1参与了肝癌的代谢重编程(Nature Commun,2023)。
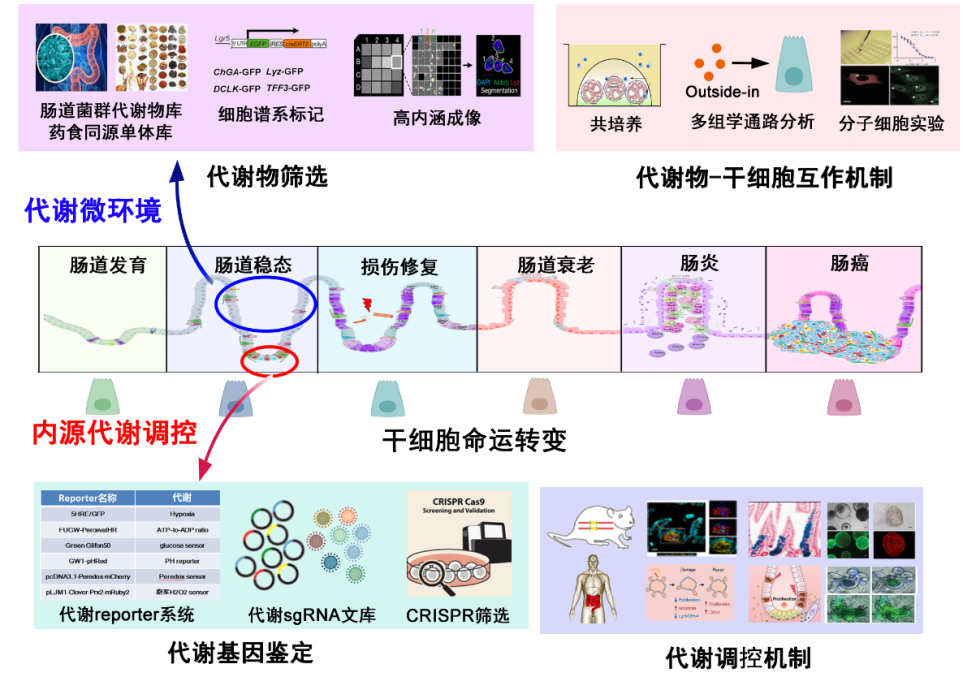
未来规划
未来工作中,我们将从微环境调控和细胞内源性调控两个方向,研究肠道干细胞及肿瘤干细胞在器官损伤修复、器官衰老和炎癌发生过程中的代谢调控。微环境方向,我们重点关注免疫微环境,利用高内涵成像筛选,明确微环境中有功能的免疫因子,并通过共培养体系研究代谢物调控干细胞功能维持和命运转变的机制;内源性调控方向,我们将结合代谢reporter系统、代谢sgRNA文库和CRISPR筛选,鉴定调控代谢的新因子和新通路,并利用基因敲除小鼠、iPSC定向分化等模型,研究这些代谢因子调控干细胞的分子机制。具体如下图所示