2025年3月3日,中国科学院生物物理研究所范祖森教授团队与郑州大学医学科学院、天健先进生物医学实验室刘本宇教授、范新娟教授团队合作,在国际免疫学领域权威杂志《Nature Immunology》发表了题为“Enteric GABAergic neuron-derived γ-aminobutyric acid initiates expression of Igfbp7 to sustain ILC3 homeostasis”的研究成果,该工作揭示了肠内γ-氨基丁酸能神经元来源的GABA通过启动Igfbp7的表达来抑制ILC3炎症性活化,从而维持肠道的免疫稳态。
固有淋巴样细胞(innate lymphoid cells, ILC)在组织稳态维持和炎症反应调控过程中发挥着重要的作用。ILC表达多种环境信号识别受体,能够识别包括菌群、食物来源代谢物、神经递质以及神经肽等微环境中的信号因子调控免疫应答。其中,ILC3特征性表达转录因子RORγt,活化后产生IL-22、IL-17A以及GM-CSF等细胞因子,参与促进淋巴组织形成和维持黏膜完整性等过程。然而,神经信号调控ILC3功能的分子机制尚未完全明晰。
研究团队利用神经递质化合物库筛选发现神经递质GABA抑制ILC3的活化,并且ILC3表达代谢型GABA受体Gabbr1/2。条件性敲除Gabbr1导致ILC3增殖以及炎性细胞因子IL-17A的表达增加,小鼠出现自发性肠炎,并且会进一步加重DSS和TNBS诱导的肠道炎症。肠道中GABA主要由γ-氨基丁酸能神经元产生,特征性表达Gad2,并且Gad2敲除或γ-氨基丁酸能神经元的删除同样促进ILC3产生IL-17A和加剧肠炎症状。机制表明,GABA-Gabbr1/2-Ca2+信号轴抑制C/EBP-β在ILC3中的表达,而C/EBP-β在ILC3中主要表达转录抑制性LIP亚型,并通过PRC2复合物介导的H3K27me3修饰抑制Igfbp7的表达。因此,GABA信号通过双重抑制作用维持Igfbp7的表达与分泌,Igfbp7以自分泌的方式抑制IL-17A的产生,从而维持肠道免疫稳态。
该工作得到英国曼彻斯特大学Matthew R. Hepworth教授的高度评价,指出“该研究工作提供了对肠道神经系统与组织驻留免疫系统间的复杂调控互作的新见解,为肠道炎症性疾病的致病机理起到了新的启发作用”。
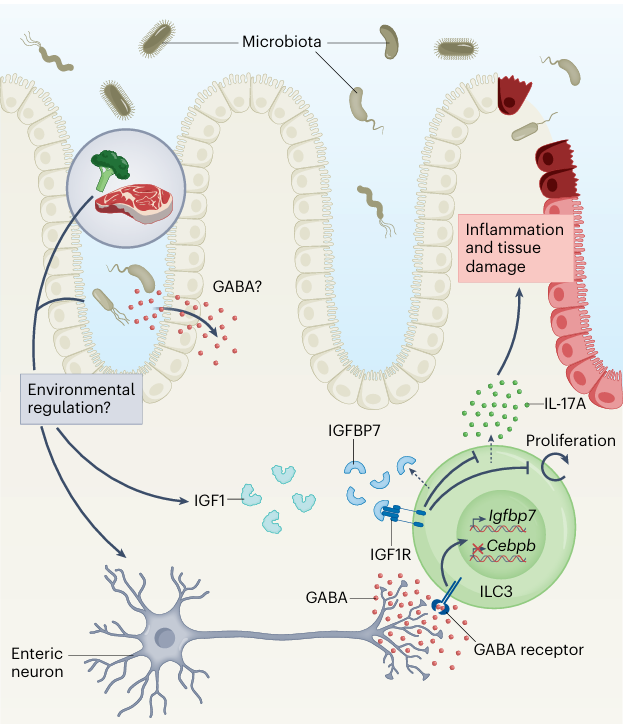
图形摘要:肠道神经来源GABA抑制ILC3活化从而抑制炎症疾病
(图源:Hepworth, M.R. Nature Immunology. 2025)
中国科学院生物物理研究所范祖森教授和郑州大学医学科学院、天健先进生物医学实验室刘本宇教授、范新娟教授为该文章的共同通讯作者,教师刘念、研究员王云龙,研究生贺佳诚、杨艳梅和张凌蔚为该论文的共同第一作者。该研究成果得到科技部重点研发计划、国家自然科学基金和天健先进生物医学实验室等资助。由中国科学院生物物理研究所、郑州大学医学科学院、天健先进生物医学实验室和郑州大学第一附属医院共同完成。
文章链接:https://www.nature.com/articles/s41590-025-02081-2