李建波等人在2022年1月发表于中科院一区、郑州大学top期刊杂志“Journal of Controlled Release”上的文章“Oral insulin delivery by epithelium microenvironment-adaptive nanoparticles” 。
影响因子:IF 9.776

研究背景及目的
口服给药因其便利性以及良好的患者依从性,已成为蛋白多肽类药物最热门的研究方向之一。近年来,纳米载体显示出了口服递送蛋白多肽类药物的巨大潜力。要使药物被有效吸收进入血液循环,纳米载体需先后克服肠道表面的粘液扩散屏障以及肠上皮细胞吸收屏障。而克服这两个生物屏障所需纳米载体的表面性质是相互矛盾的。精准调控纳米载体呈现所需的表面性质,使其能够逐级穿越两种屏障达到高效的药物吸收,是利用纳米载体提高药物口服生物利用度的关键。本研究基于空肠上皮细胞表面的酸性微环境(pH介于5.3-6.0之间),拟通过智能生物响应原理精准调控纳米载体的表面性质,使其在粘液扩散和上皮细胞吸收所需性质之间转变,构建一种可逐级“动态”跨越粘液层和上皮细胞两种屏障的口服纳米给药系统。
主要研究结果
1、纳米材料的合成
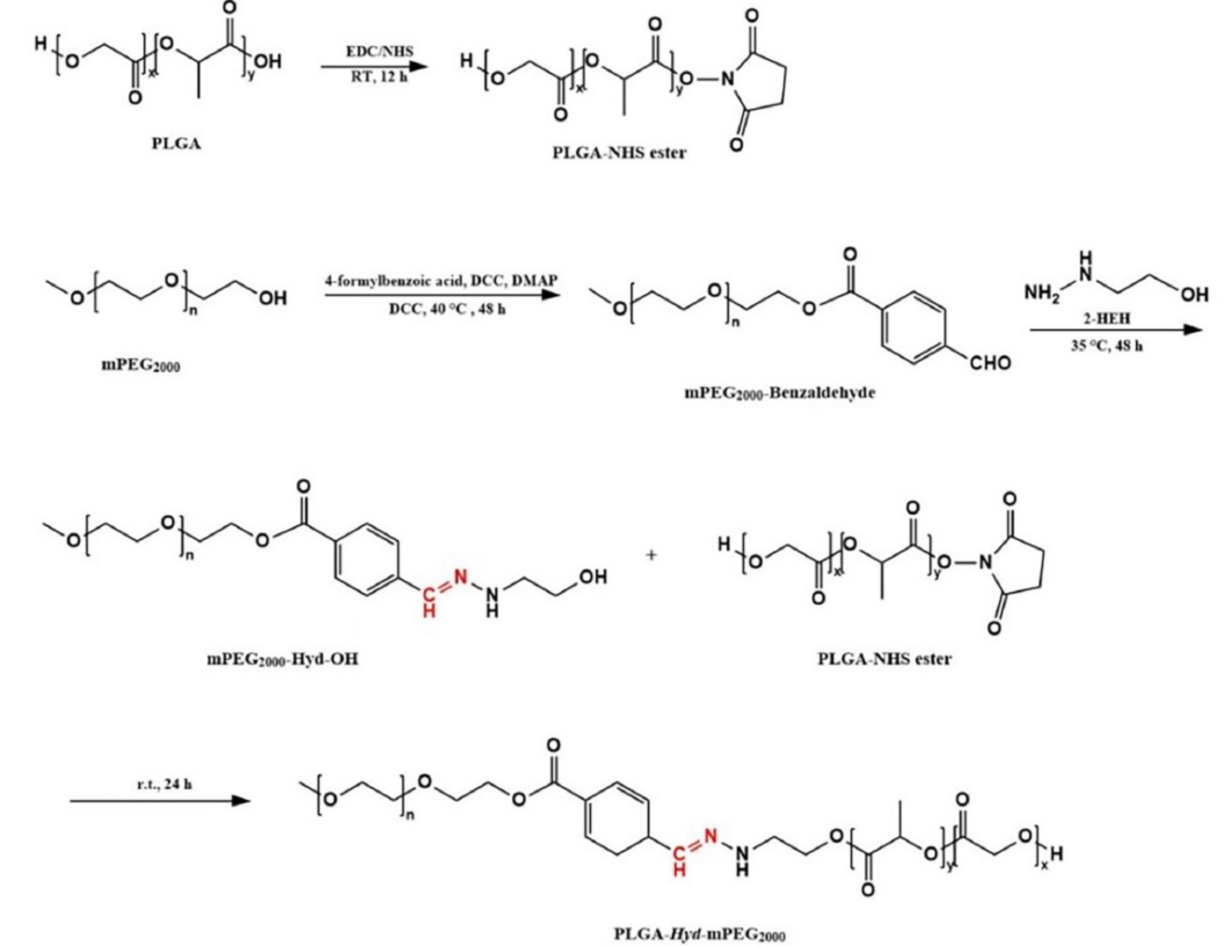
通过核磁共振氢谱和傅立叶变换红外光谱对产物进行了表征,结果证实PEG-Hyd-PLGA载体材料成功制备。
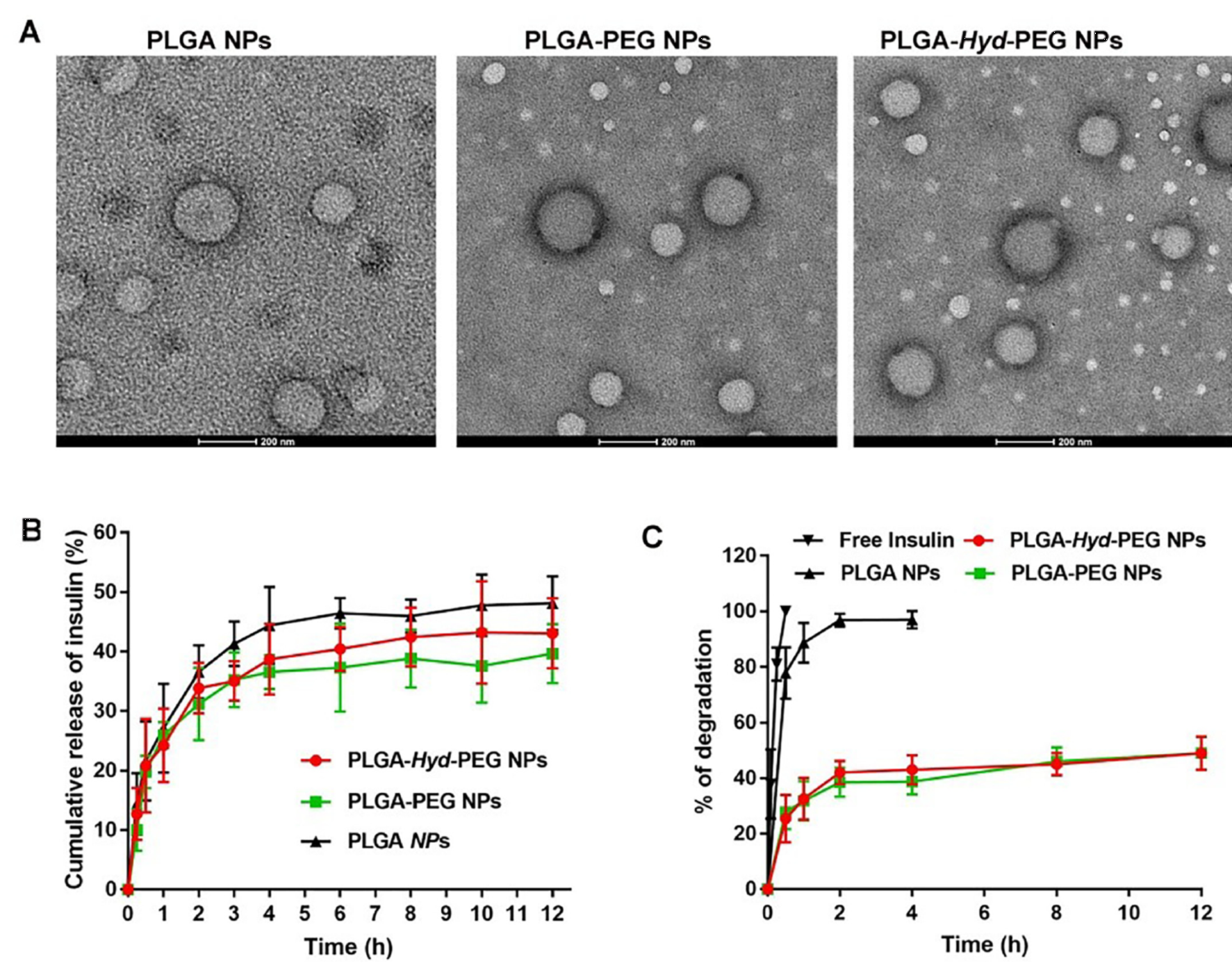
2、纳米粒的制备和体外性质研究
通过复乳/溶剂挥发法制备包载胰岛素的PEG-Hyd-PLGA纳米粒,纳米粒平均粒径为139.6 ± 1.1 nm,PDI为0.169 ± 0.021,Zeta电位为-32.8 ± 0.7 mV,包封率为48.03 ± 3.30%,载药量为4.65 ± 0.30%。结果表明制备的纳米粒呈类圆形的粒子,分散良好,粒径大小分布均匀。纳米粒中胰岛素在pH 6.8的PBS缓冲液中呈现出先突释然后缓慢释放的释药行为。
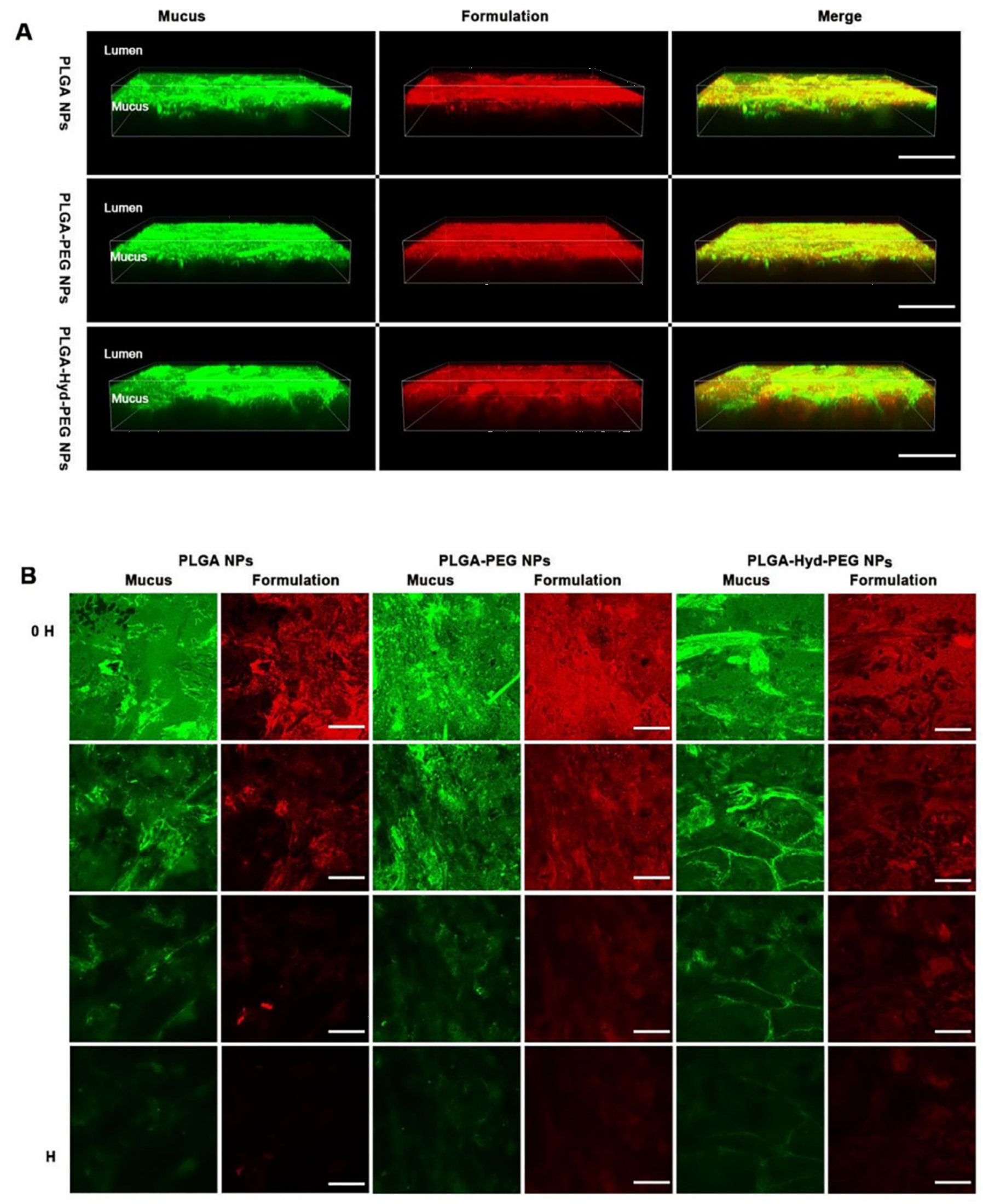
3、粘液穿透试验
我们采用空肠粘液研究了PEG-Hyd-PLGA、PEG-PLGA和PLGA三种纳米粒的粘液穿透行为。从PEG-Hyd-PLGA和PEG-PLGA纳米粒组的3D图像可以看到,纳米粒(红色)扩散到了粘液(绿色)深层,说明纳米粒具有较好的粘液扩散性能。这是由于粘液惰性材料PEG的包裹,使其表面具有亲水性,大大减弱了粘液蛋白对纳米粒的吸附和清除作用,使两者具有更好的粘液渗透能力,能够到达深层粘液处。而相比之下,PLGA纳米粒(红色)几乎都限于靠近肠腔的上层粘液层(绿色)中,穿透粘液量大大减少,这是由于其较强的表面疏水性,与粘液的相互作用更强,导致无法更好地穿透粘液。
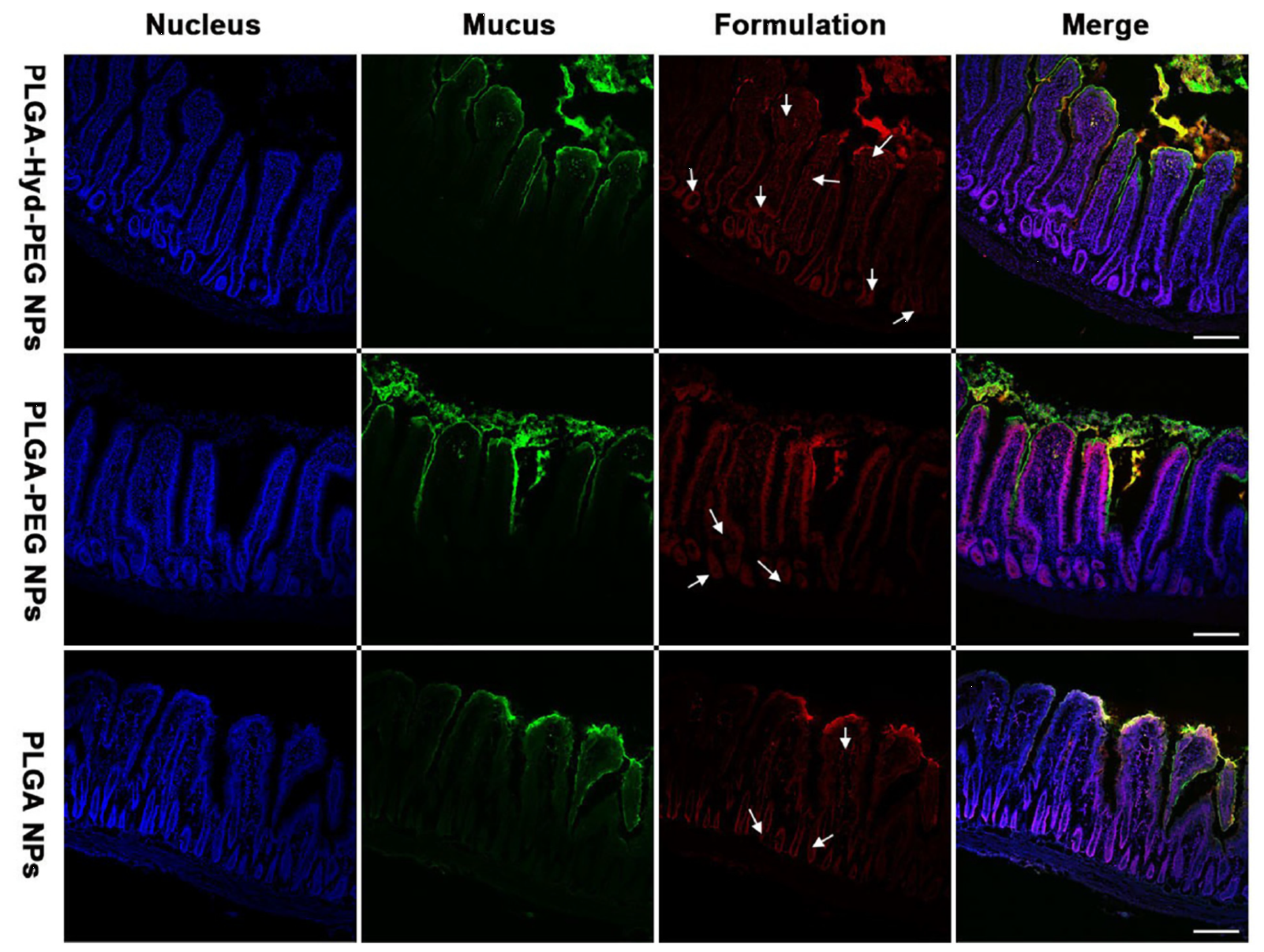
4、在体肠吸收实验
PEG-Hyd-PLGA、PEG-PLGA和PLGA三种纳米粒在体空肠吸收实验的结果如图所示。可以明显地看出,在肠绒毛的周围覆盖有粘液层,PLGA纳米粒更多的聚集于肠腔侧的绒毛顶端处,少部分能够到达绒毛的深部,而PEG-Hyd-PLGA和PEG-PLGA纳米粒在肠绒毛周围分布较均匀,没有被粘液所阻碍。PEG-PLGA纳米粒由于表面亲水性使得其被上皮细胞吸收的能力差,大部分纳米粒沿着肠绒毛分布,与粘液层重合。PLGA纳米粒由于表面疏水性,少量没有被粘液阻碍的纳米粒能够较好地被上皮细胞吸收。相较于PEG-PLGA和PLGA纳米粒,PEG-Hyd-PLGA纳米粒则被肠绒毛更多地吸收。
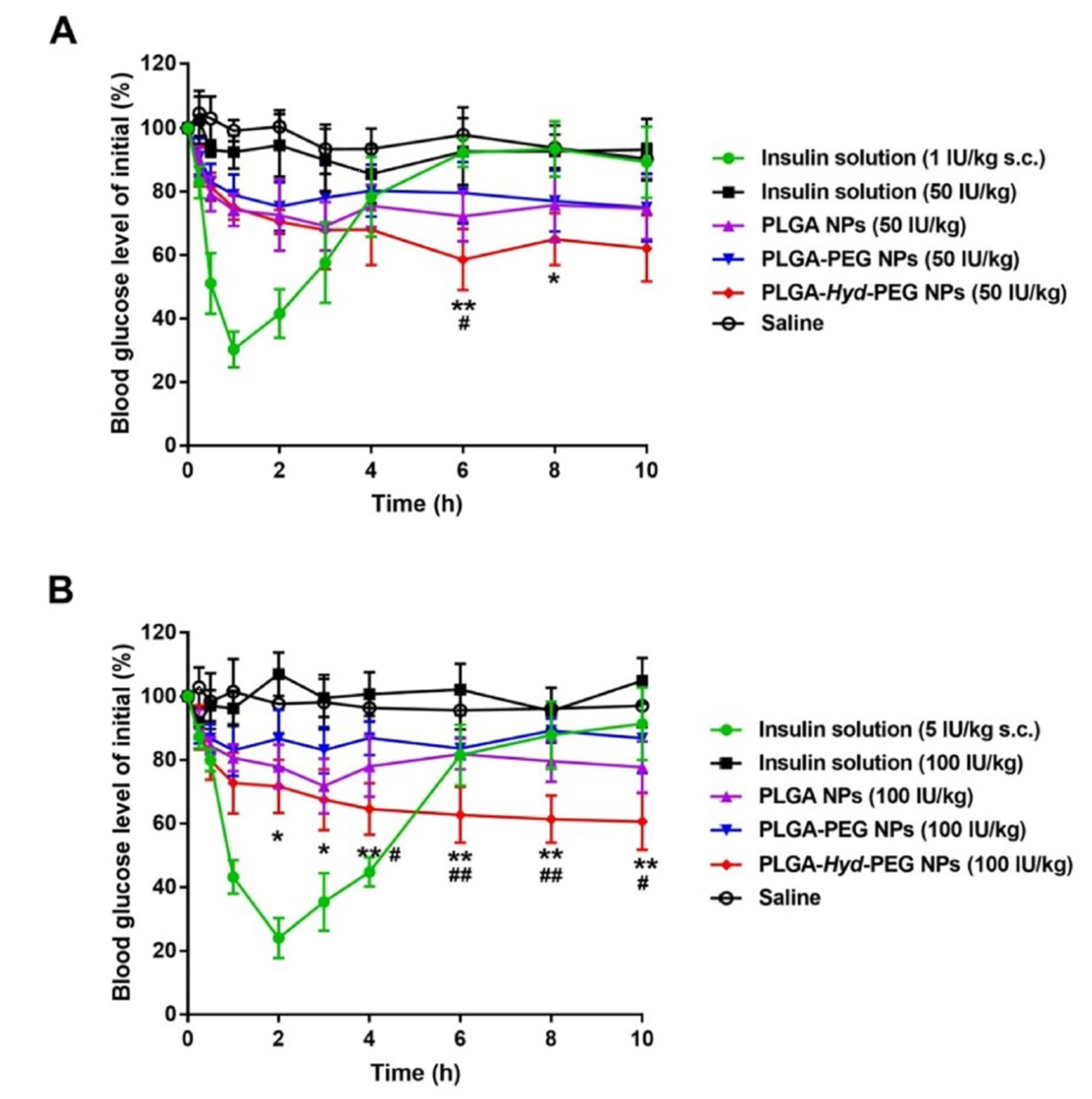
5、降血糖作用研究
为了检测胰岛素纳米粒的降血糖作用,将每种制剂通过空肠内注射给正常(A)和糖尿病大鼠(B),并监测血糖 10小时。皮下注射生理盐水对血糖无影响,而游离胰岛素在1h内降低,随后升高至基线水平。口服给予PLGA-HYD-PEG NPs、PLGA-PEG NPs或PLGA NPs的糖尿病大鼠也观察到血糖降低然后升高。值得注意的是,PLGA-HYD-PEGNPs可引起最强的降糖反应,使糖尿病大鼠的血糖在3h内下降33%,随后在10h时降至平台期的62%,而PLGA-HYD-PEGNPs和PLGA-PEGNPs仅轻微降低糖尿病大鼠的血糖,保持在80%左右。有趣的是,多种胰岛素口服纳米制剂给药后,正常大鼠表现出与糖尿病大鼠相似的降糖趋势。在糖尿病大鼠中,PLGA-HYD-PEGNPs组的PA为4.81%,是PLGA NPs组的1.6倍和PLGA-PE GNPs组的2.4倍。
评论
受空肠上皮细胞表面酸性微环境的启发,本研究设计和合成了一种可生物降解的共聚物PLGA-Hyd-PEG,构建了pH敏感的、具有核-壳结构的胰岛素口服纳米给药系统。PLGA-Hyd-PEG纳米粒具有良好的稳定性和快速的粘液渗透能力,在空肠上皮表面的酸性微环境(pH~5.5)中,亲水性PEG脱落,从而使纳米颗粒表面由亲水转变为疏水,从而促进内化进入细胞,药效学研究表明,正常和糖尿病大鼠的血糖水平均显著降低。该种口服递药策略之前未见报道,本研究为大分子蛋白多肽类药物的口服给药系统研究提供了新的思路和实践基础。该研究获得了国家自然科学基金、河南省重点研发与推广专项及河南省医药科学研究院基本业务费的支持。
第一作者简介

李建波,靶向药物设计学博士,郑州大学直聘副教授,硕士生导师,郑州大学河南省医药科学研究院药物研究所所长,河南省药学会药剂专委会委员,河南省药理学会肿瘤药理专委会委员。主要从事纳米给药系统及小分子前体药物等方面的研究,主持国家自然科学基金项目1项、河南省重点研发与推广专项项目1项,近5年来申请国家发明专利9项,发表SCI文章14篇。

